Se forman por la combinación de iónes únidos al ión óxido (O -2). La composición en su fórmula se especifíca indicando primero la parte postiva (el metal) y luego la negativa (el oxígeno).
Se nombran indicando el número de veces que aparece el anión óxido mediante los prefijos multiplicadores, mas la raíz del oxígeno seguido del sufijo ''o'', la preposición ''de'', el número de veces que aparece el ión metálico con los prefijos multiplicadores, mas la raíz del metal y al final el sufijo ''o''. por ejemplo:
Na (+1) + O (-2) = Na2O = Óxido de Sodio
sábado, 10 de diciembre de 2011
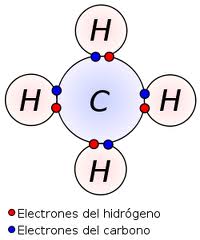
Hidrácidos (H +1)
Se forman con la combinación del hidrógeno con no metales de lo grupos 16 y 17 a exepción del oxígeno que este caso formaría agua.
Sus formulas se integran con los símbolos del hidrógeno en primer lugar y el símbolo del no metal a continuación se nombran anteponiendo el nombre ácido después del nombre del no metal más la terminación hídrico. Ejemplo:
H + F = HF = Ácido Flourhídrico
Sus formulas se integran con los símbolos del hidrógeno en primer lugar y el símbolo del no metal a continuación se nombran anteponiendo el nombre ácido después del nombre del no metal más la terminación hídrico. Ejemplo:
H + F = HF = Ácido Flourhídrico
Hidruros Metálicos (H -1)
Se forman por iones metálicos de los grupos I y II unidos al ión hidruro (H -1)
La composición en su fórmula se especifíca indicando primero la parte positiva (el metal) y luego la negativa. Sus nombres se forman nombrando primero la raíz del hidrógeno con terminación URO luego la preposición DE la raíz del metal. Ejemplo:
Li + H = LiH = HidrUO DE Litio
La composición en su fórmula se especifíca indicando primero la parte positiva (el metal) y luego la negativa. Sus nombres se forman nombrando primero la raíz del hidrógeno con terminación URO luego la preposición DE la raíz del metal. Ejemplo:
Li + H = LiH = HidrUO DE Litio
Clasificación de algunos compuestos inorgánicos
1) Compuestos con hidrógeno (Hidruros Metálicos, Hidrácidos)
2) Compuestos con Oxígeno (Óxido Metálicos, Óxidos no Metáles)
3)Compuestos con hidrógeno y oxígeno (Hidróxidos, Oxiácidos)
2) Compuestos con Oxígeno (Óxido Metálicos, Óxidos no Metáles)
3)Compuestos con hidrógeno y oxígeno (Hidróxidos, Oxiácidos)
Propiedades del Enlace Metálico
*Sólidos a temperatura ambiente
*Buenos conductores de calor y electricidad
*Dúctiles y maliables
*Lared cristalina es difiícil de romper
*Buenos conductores de calor y electricidad
*Dúctiles y maliables
*Lared cristalina es difiícil de romper
Enlace metálico
Se dan entre átomos de un mismo elemento metálico, estos pueden forma únicamente Iónes positivos (cationes). No es posible la formación de enlaces Iónicos ni covalentes.
Los átomos se unen entre si formando un cristal metálicos o red, en la cual los electrones de las últimas capas de los átomos pretencen a todos los átomos del cristal
Los átomos se unen entre si formando un cristal metálicos o red, en la cual los electrones de las últimas capas de los átomos pretencen a todos los átomos del cristal
Propiedades del enlace covalente
*Bajos puntos de fución y ebullición por lo que son gases o líquidos a temperatura ambiente
*Insolubles en agua
*No son conductores electricos aunque si lo es el grafito
*Enlaces muy fuertes entre los átomos
*Su estructura no presenta iones
*No hay carga electrica en su estructura
*Insolubles en agua
*No son conductores electricos aunque si lo es el grafito
*Enlaces muy fuertes entre los átomos
*Su estructura no presenta iones
*No hay carga electrica en su estructura
Enlace covalente
Tiene lugar COMPARTIENDO pares de electrones, en determinadas circunstancias pueden formar cristales covalentes, ejemplo: diamantes
Propiedades de los compuestos Iónicos
*Son sólidos a temperatura ambiente, ejemplo: sal
*Altos puntos de fución y ebullición
*Duros y frágiles
*Solubres en agua
*No son conductores electricos en estado sólido, pero si disueltos o fundidos
*Altos puntos de fución y ebullición
*Duros y frágiles
*Solubres en agua
*No son conductores electricos en estado sólido, pero si disueltos o fundidos
Enlace químico
Interacción entre dos o mas partículas mediante fuerzas de atracción:
*Enlace Iónico
*Enlace covalente
*Enlace Metálico

*Enlace Iónico
*Enlace covalente
*Enlace Metálico

viernes, 9 de diciembre de 2011
propiedades físicas y químicas de los elementos de la tabla periódica
numero de oxidacion: se refiere al numero de electrones que puede ganar o perder un átomo al unirse con otro. esta formado por numero atómico, numero de oxidación, símbolo, masa atómica.
radio atomico: se refiere al tamaño de los átomos esta caracteriza presenta un comportamiento periódico en la tabla pues al recorrerla de izquierda a derecha daria sistemáticamente. el elemento mas grande en cuanto a su tamaño es el Fr.
electro negatividad: es la capacidad de un átomo para atraer a si mismo los electrones de enlace F (mas electronegativos)
energía de ionización: es una medida de la energía necesaria para remover un electrón del átomo de una sustancia que se encuentra en estado gracioso es decir, que no se encuentra ineracionado con otros átomos. presenta el mismo comportamiento de la electronegatividad
afinidad electrónica se refiere a la avilidad de los átomos para aceptar un electrón extra y se obtiene midiendo la energía necesaria para arrancar un electrones a un ion también conside con la electronegatividad.
radio atomico: se refiere al tamaño de los átomos esta caracteriza presenta un comportamiento periódico en la tabla pues al recorrerla de izquierda a derecha daria sistemáticamente. el elemento mas grande en cuanto a su tamaño es el Fr.
electro negatividad: es la capacidad de un átomo para atraer a si mismo los electrones de enlace F (mas electronegativos)
energía de ionización: es una medida de la energía necesaria para remover un electrón del átomo de una sustancia que se encuentra en estado gracioso es decir, que no se encuentra ineracionado con otros átomos. presenta el mismo comportamiento de la electronegatividad
afinidad electrónica se refiere a la avilidad de los átomos para aceptar un electrón extra y se obtiene midiendo la energía necesaria para arrancar un electrones a un ion también conside con la electronegatividad.
organización de la tabla periodica
consta de 18 columnas llamadas grupos o familias A(elementos representativa) B (elementos de transición)
& de 7 filas llamas periodos.
se encuentra dividida por una linea quebrada que divide a los metales de los no metales.
la tabla esta organizada en base al numero atómico es por ello que se encuentra de manera creciente, sin embargo el numero atómico 57 del ``La´´ existe un ``salto´´ solo es porque a partir del numero 58...71 estos elementos se comportan de manera similar al La. lo mismo ocurre con Ac 90...73.
& de 7 filas llamas periodos.
se encuentra dividida por una linea quebrada que divide a los metales de los no metales.
la tabla esta organizada en base al numero atómico es por ello que se encuentra de manera creciente, sin embargo el numero atómico 57 del ``La´´ existe un ``salto´´ solo es porque a partir del numero 58...71 estos elementos se comportan de manera similar al La. lo mismo ocurre con Ac 90...73.
tabla periodica
los primeros intentos para construir una tabla periódica fue tener un listado de los elementos químicos. en 1789 la voisier incluye en la clasificación a aquellos elementos que se encuentran libres en la naturaleza ejemplo: Au, Ag, Cu, C, Sn, Pb,S.
En su clasificacion también se registraron elementos descubiertos desde la edad media ejemplo P,As.
El trabajo de la voisier solo nos podía indicar algunas características entre estos elementos.
En su clasificacion también se registraron elementos descubiertos desde la edad media ejemplo P,As.
El trabajo de la voisier solo nos podía indicar algunas características entre estos elementos.
lunes, 5 de diciembre de 2011
REGLAS PARA LA ELABORAR CONFIGURACIÓN ELECTRÓNICA
Los electrones deben acomodarse primero en los orbitales de menor energía, o sean aquellos donde la suma del n+1 sea menor es decir`` cada nuevo electrón añadido a un átomo entrara en el orbital disponible de menor energía a la separación de energía en los subniveles de los átomos polielectronicos originan una super posición o empalme del valor de n, en otras palabras aplicaremos la regla de Hun o regla de los diagonales.
1s
2s 2p s=2 electrones
3s 3p 3d p=6 electrones
4s 4p 4d 4f d=10 electrones
5s 5p 5d 5f f=14 electrones
6s 6p 6d 6f
7s 7p 7d 7f
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 6f 7d 7f
MODELOS ATÓMICO
DALTON
Dalton propone el modelo atómico mas sencillo que se conoce basado en una partícula esferica diminuta donde todo la materia se compone de ellas formando agrupamientos para los distintos estados (solido, liquido, gas) el propone que esta partícula es indivisible y recibe el nombre de átomo
THOMPSON
propone el modelo del ``budín de pasa´´ que junto con los estidios de milican incluye ya las particulas negativas llamadas electrones(e-) el dice que el atomo es una esfera grande positiva y que en su interior se encuentran incrustados los electrones como si fuera un budín de pasas.
RUTHERFORD
propone la conformación de los electrones girando al rededor de núcleo atómico, esto es como un pequeño sistema solar en miniatura con sus diferentes niveles de energía donde se ubican los electrones.
SOMMERFRETD
sommerfeld propone orbitale electivas para los electrones y velocidades relativas el postulo que el núcleo del átomo no permanece inmóvil, sino que tanto el núcleo como el electrón se mueven al rededor del centro de masa del sistema, que estar situado muy próximo al núcleo al tener esta una masa miles de veces superior a la masa del electrón.
1. los electrones se mueven al rededor del núcleo en orbitales eléctricas
2. a partir del segundo nivel energético existen dos o mas en el mismo nivel
3. el electrón es una corriente eléctrica minúscula.
CHADWICK
Propuso que la radiación descubierta por bother y becker estada formada por partículas. calcula que las partículas añadidas al boro tenia una masa mas o menos igual a la del proton, sin embargo no se podía detectar su carga por lo que el sugirió que no poseía carga. esta nueva partícula fue llamada neutron por su carencia de carga eléctrica los neutrones se encuentran junto con los protones en el núcleo.
Dalton propone el modelo atómico mas sencillo que se conoce basado en una partícula esferica diminuta donde todo la materia se compone de ellas formando agrupamientos para los distintos estados (solido, liquido, gas) el propone que esta partícula es indivisible y recibe el nombre de átomo
THOMPSON
propone el modelo del ``budín de pasa´´ que junto con los estidios de milican incluye ya las particulas negativas llamadas electrones(e-) el dice que el atomo es una esfera grande positiva y que en su interior se encuentran incrustados los electrones como si fuera un budín de pasas.
RUTHERFORD
propone la conformación de los electrones girando al rededor de núcleo atómico, esto es como un pequeño sistema solar en miniatura con sus diferentes niveles de energía donde se ubican los electrones.
SOMMERFRETD
sommerfeld propone orbitale electivas para los electrones y velocidades relativas el postulo que el núcleo del átomo no permanece inmóvil, sino que tanto el núcleo como el electrón se mueven al rededor del centro de masa del sistema, que estar situado muy próximo al núcleo al tener esta una masa miles de veces superior a la masa del electrón.
1. los electrones se mueven al rededor del núcleo en orbitales eléctricas
2. a partir del segundo nivel energético existen dos o mas en el mismo nivel
3. el electrón es una corriente eléctrica minúscula.
CHADWICK
Propuso que la radiación descubierta por bother y becker estada formada por partículas. calcula que las partículas añadidas al boro tenia una masa mas o menos igual a la del proton, sin embargo no se podía detectar su carga por lo que el sugirió que no poseía carga. esta nueva partícula fue llamada neutron por su carencia de carga eléctrica los neutrones se encuentran junto con los protones en el núcleo.
domingo, 4 de diciembre de 2011
números cuánticos
NUMERO CUÁNTICO ``N´´
llamado también numero cuántico principal puede tomar los siguientes valores
n=1
n=
n=3 indica en que nivel energetico es posible encontrar al electron
n=4
n=5
n=6
n=7
NUMERO CUÁNTICO ``L´´
llamado numero cuántico secundario, nos indica el tipo de subnivel donde se localiza el electrón y puede tomar los sig. valores n-1(numero cuántico principal) pasando por el cero
l=0 subnivel tipo ``s´´
l=1 subnivel tipo ``p´´
l=2 subnivel tipo ``d´´
l=3 subnivel tipo ``f´´
si n=1 l=0= orbital tipo ``s´´
si n =2 l=0= orbital tipo ``s´´
l=1= orbital tipo ``p´´
si n =3 l=0= orbital tipo ``s´´
l=1= orbital tipo ``p´´
l=2= orbital tipo ``d´´
si n =4 l=0= orbital tipo ``s´´
l=1= orbital tipo ``p´´
l=2= orbital tipo ``d´´
l=3= orbital tipo ``f´´
NUMERO CUÁNTICO ``m´´
llamado también numero cuántico magnetico este numero nos indica el tipo del orbital que contiene cada subnivel y toma los siguientes valores
l=0= (2(0)+1)=1 por lo tanto m=1
l=1=(2(1)+1)=3 por lo tanto m= -1, 0, +1
l=2=(2(2)+1)=5por lo tanto m= -2 -1 0 1 2
l=3=(2(3)+1)=7 por lo tanto m=-3 -2 -1 0 1 2 3
NUMERO CUÁNTICO ``s´´
llamado también numero cuántico ``3pin´´ nos indica el posible giro del electrón ademas de que c/u de los orbitales contiene como máximo 2 electrones (+) (-)
llamado también numero cuántico principal puede tomar los siguientes valores
n=1
n=
n=3 indica en que nivel energetico es posible encontrar al electron
n=4
n=5
n=6
n=7
NUMERO CUÁNTICO ``L´´
llamado numero cuántico secundario, nos indica el tipo de subnivel donde se localiza el electrón y puede tomar los sig. valores n-1(numero cuántico principal) pasando por el cero
l=0 subnivel tipo ``s´´
l=1 subnivel tipo ``p´´
l=2 subnivel tipo ``d´´
l=3 subnivel tipo ``f´´
si n=1 l=0= orbital tipo ``s´´
si n =2 l=0= orbital tipo ``s´´
l=1= orbital tipo ``p´´
si n =3 l=0= orbital tipo ``s´´
l=1= orbital tipo ``p´´
l=2= orbital tipo ``d´´
si n =4 l=0= orbital tipo ``s´´
l=1= orbital tipo ``p´´
l=2= orbital tipo ``d´´
l=3= orbital tipo ``f´´
NUMERO CUÁNTICO ``m´´
llamado también numero cuántico magnetico este numero nos indica el tipo del orbital que contiene cada subnivel y toma los siguientes valores
l=0= (2(0)+1)=1 por lo tanto m=1
l=1=(2(1)+1)=3 por lo tanto m= -1, 0, +1
l=2=(2(2)+1)=5por lo tanto m= -2 -1 0 1 2
l=3=(2(3)+1)=7 por lo tanto m=-3 -2 -1 0 1 2 3
NUMERO CUÁNTICO ``s´´
llamado también numero cuántico ``3pin´´ nos indica el posible giro del electrón ademas de que c/u de los orbitales contiene como máximo 2 electrones (+) (-)
principio de incertidumbre de heinsenberg
nos dice que no es posible conocer con exactitud la posicion exacta del electro. sin embargo para ello se utilizan los numeros cuánticos donde
N (nos indica nivel de energía)
L(sub nivel)
M(orbital)
S (giro)
N (nos indica nivel de energía)
L(sub nivel)
M(orbital)
S (giro)
ESTRUCTURA ATÓMICA
Todos los científicos que estudiaron el modelo atómico llegaron a la conclusión que el atomo esta constituido principalmente por un núcleo atomico y niveles de energía.
de esta manera estamos en la posibilidad de describir una partícula subatomica (bajo o de bajo de) proton: partícula subatomica localizada en el núcleo del átomo 1 uma (unidad de masa atómica)(p+) electrón: partcula subatomica localizada en los niveles energeticos.(e-) neutron: particula subatomica localizada en el núcleo 1 uma aparese sin carga electrica.
de esta manera estamos en la posibilidad de describir una partícula subatomica (bajo o de bajo de) proton: partícula subatomica localizada en el núcleo del átomo 1 uma (unidad de masa atómica)(p+) electrón: partcula subatomica localizada en los niveles energeticos.(e-) neutron: particula subatomica localizada en el núcleo 1 uma aparese sin carga electrica.
masa atómica: ``A´´es la masa del propio átomo (núcleo)
A=P+N
N° atómico: ``Z´´ el atomo es electricamente ``neutro´´ es decir
P=E
por lo tanto el Z es la cantidad de P o E que contiene un átomo
jueves, 1 de diciembre de 2011
ANTECEDENTES HISTÓRICOS DE LOS MODELOS ATOMICOS
1-Aristoteles: consideraba que la materia estaba formada por 4 elementos fuego, tierra, agua, aire. los indues y los japoneses consideraban 5 elementos los 4 anteriores y el eter.
2-Democrito: planteo que la materia estaba constituida por pequeñas partículas llamadas átomos.
3-Dalton: postulo la ley de las proporciones múltiples y diferencio entre átomos y moléculas
4-Willian Crookes: descubrió los rayos catodicos que se utilizan aun para las televisiones.
5-Thompson: suponía que el átomo era una esfera grande positiva con electrones incrustados.
6-Goldstein: descubre el proton con carga positiva.
7-Becquerel: precursor para descubrir el electrón.
8-Ruthetford: descubre los rayos alfa, beta y gama. y supone un modelo de un sistema solar en miniatura.
9-Chadwick: descubre el neutron que no tiene carga y se encuentra en el núcleo atómico.
10-Paudirsc: describe al electrón como un modelo de onda que vibra
Suscribirse a:
Entradas (Atom)